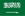1. Su moleküllerinin doğrudan ayrışması ve adsorpsiyonu
Metal oksitlerin veya yarı iletken oksitlerin (Ti4+, Fe3+ gibi) doymamış metal bölgelerinde, su molekülleri ilk önce moleküler formda adsorbe edilir, ardından O-H bağ bölünmesi gerçekleşir ve sonuçta köprü veya terminal hidroksil grupları (M-OH) ve yüzey hidrojen atomları oluşur. Bu sürecin termodinamik itici gücü, metal iyonlarının güçlü Lewis asiditesinden gelir ve bu da su moleküllerinin ayrışmasını kolaylaştırır. Hem deneyler hem de DFT hesaplamaları, düşük oksijenle kaplı yüzeylerin ayrışma ve adsorbe etme eğiliminde olduğunu, yüksek oksijenle kaplı yüzeylerin ise molekülleri adsorbe etme eğiliminde olduğunu göstermektedir.
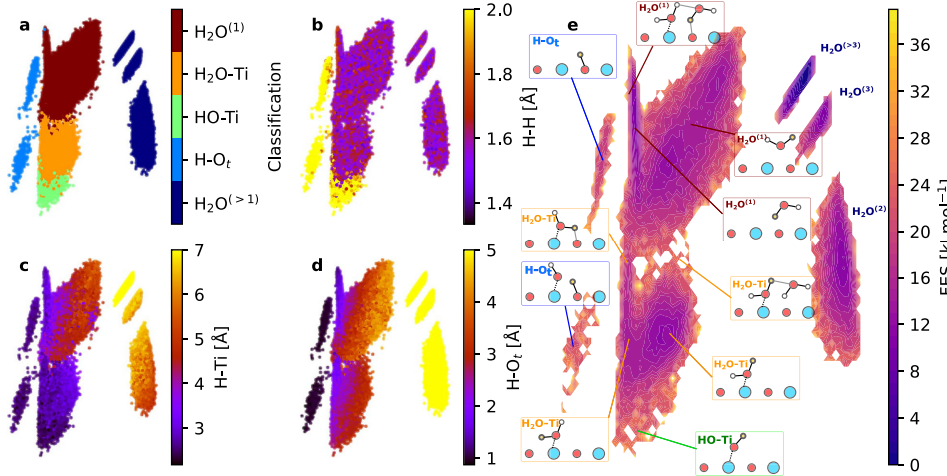
2.Oksijen boşluğu (VO) aracılı hidroksil üretimi
Yüzeydeki oksijen boşlukları elektron sağlayarak adsorbe edilen su moleküllerini ayrışmaya daha yatkın hale getirir. Su molekülleri boşluğa adsorbe edildikten sonra iki hidroksil grubu oluşur; bunlardan biri boşluğu doldurur, diğeri ise bitişikteki metale asılır. Bu mekanizma, indirgeyici veya yüksek sıcaklık koşulları altında hidroksil yoğunluğundaki önemli artış olgusunu açıklar ve metal iyonlarının koordinasyon sayısındaki değişikliklerle yakından ilişkilidir.
3.Hidrojen veya hidrojen atomu taşması
Metal/oksit arayüzünde H2, metal üzerinde H ⁺/H ⁻ oluşturmak üzere ayrışır, bu daha sonra hidrojen taşması yoluyla metal oksidin yüzeyine göç eder ve yüzey oksijeni ile hidroksil grupları oluşturur. Bu işlem, düşük sıcaklıktaki CO oksidasyonu gibi katalitik sistemlerde doğrudan gözlemlendi ve hidrojen taşması, yüzey hidroksil grubu oluşum hızını önemli ölçüde artırdı.
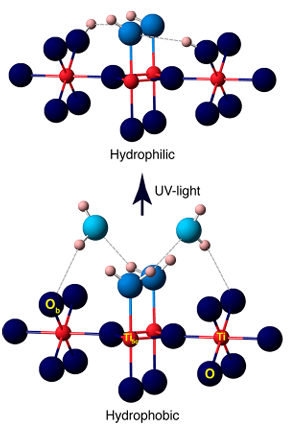
4.Fotokatalitik/UV kaynaklı hidroksil oluşumu
UV ışığı, TiO2 gibi yarı iletkenleri uyararak yüzeydeki oksijen atomlarını yakalayarak O ⁻ oluşturan elektron deliği çiftleri oluşturur ve daha sonra adsorbe edilmiş su molekülleri veya hidroksil gruplarıyla reaksiyona girerek yüzey OH ⁻ üretir ve buna hidroksil radikallerinin (·OH) üretimi eşlik eder. Deneyler, UV ışınlamasının TiO2 yüzeyinde ek oksijen boşlukları oluşturduğunu, bunların suyla daha fazla reaksiyona girerek daha fazla hidroksil grubu oluşturduğunu ve bunun da foto kaynaklı süperhidrofilikliğe yol açtığını göstermiştir.
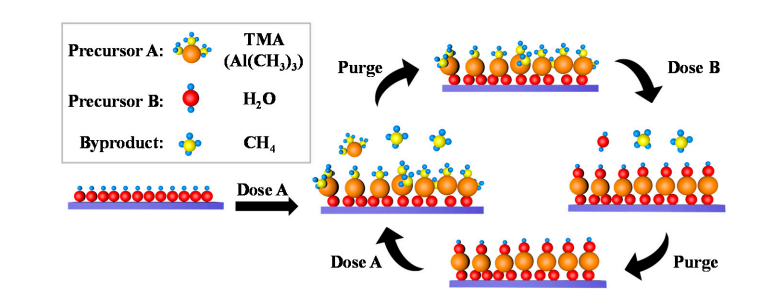
5.Alüminyum oksit yüzeyinde hidroksil gruplarının oluşumu
Alüminyum oksidin yüzeyinde az miktarda hidroksil grupları doğal olarak bulunur ve su molekülleri bu hidroksil grupları üzerinde ayrışıp adsorbe edilir ve yeni Al-OH üretilir. Atomik katman birikimi (ALD) sırasında, TMA (trimetilalüminyum), Al-O-Al bağları oluşturmak ve metan açığa çıkarmak için yüzey hidroksil gruplarıyla koordinasyon değişimine uğrar; Daha sonra su darbesi, yüzey hidroksil gruplarını yeniden oluşturmak için Al-O bağlarıyla tekrar reaksiyona girer ve hidroksil gruplarının döngüsel yenilenmesini sağlar.
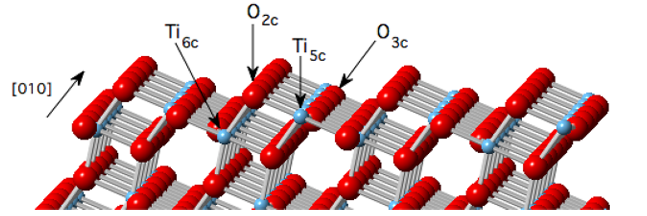
6.Yüzeyin yeniden yapılandırılması - Metal göçü hidroksil toplanmasına yol açar
Alümina veya titanyum oksidin kristal yüzeyinde, yerel metal iyonları (Al3+ gibi), yüksek sıcaklık veya yüksek hidrokimyasal potansiyel altında yüzey boşluklarına göç ederek Al (OH) 3 veya Ti (OH) 3 tipi hidroksil kümeleri oluşturur. Bu yeniden yapılanmaya, hidroksil gruplarının bitişik su molekülleri üzerindeki adsorpsiyonunu daha uygun hale getiren ve yüksek yoğunluklu bir hidroksil baz tabakası oluşturan kafes distorsiyonu eşlik eder.
7. Silikon yüzeyindeki hidroksil gruplarının hidroliz mekanizması
Si-O-Si köprü bağında su molekülleri, sinerjistik proton elektron transferi yoluyla silikon oksijen bağıyla birleşerek Si-OH grupları oluşturur. Bu süreç, çatlak ucundaki stres korozyonunda ve camın yüzey hidrolizinde özellikle önemlidir ve Si-OH çekme titreşimindeki artış, deneysel kızılötesi spektroskopiyle doğrudan gözlemlendi.
SAT NANO, Çin'deki en iyi nano toz ve mikro parçacık tedarikçisidir; karbon nanotüp tozu sunabiliriz, örneğin
MWCNT-COOH,
MWCNT-OH, herhangi bir sorunuz varsa lütfen sales03@satnano.com adresinden bizimle iletişime geçmekten çekinmeyin.